Железодефицитные состояния
у пациентов с легочной
артериальной гипертензией
Дефицит железа (ДЖ)
Нарушение, при котором количество железа в организме недостаточно для удовлетворения его потребностей и функционирования всех органов. ДЖ может быть абсолютным, когда общее количество железа в организме снижено, или функциональным, когда общее количество железа в организме нормальное или повышенное, но недостаточно для удовлетворения потребностей тканей-мишеней из-за секвестрации в пуле хранения1.
Латентный ДЖ
Железодефицитная анемия (ЖДА)
Состояние, характеризующееся истощением запасов железа в организме при нормальном уровне гемоглобина1.
Приобретенное заболевание, характеризующееся снижением содержания железа в сыворотке крови, костном мозге и тканевых депо, в результате чего нарушается образование гемоглобина и эритроцитов, развивается гипохромная анемия и трофические расстройства в тканях1.

Метаболизм железа у пациентов с ЛАГ
Исключительная роль железа определяется биологическими функциями белков, в состав которых входит этот элемент – прежде всего гемоглобина и миоглобина, в составе которых железо, доставляя кислород к тканям, обеспечивает тканевое дыхание. Железо входит также в состав большого числа ферментов, участвующих в окислительно-восстановительных реакциях, в процессе энергообразования (цитохромы), биосинтезе ДНК и делении клеток, детоксикации продуктов эндогенного распада, нейтрализующих активные формы кислорода (оксидазы, пероксидазы, каталазы и др.). Вместе с тем железо может быть токсичным элементом, если присутствует в организме в повышенных концентрациях, превышающих емкость железосодержащих белков2.
Определение
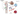
ФП – ферропортин; DCYTB – duodenal cytochrome b (дуоденальный цитохром b); DMT1 – divalent metal-ion transporter-1 (дивалентный метал-ион транспортер 1); HCP1 – Hem Carrier Protein 1 (белковый переносчик гема-1); TfR – рецептор трансферрина.
Рисунок 1. Метаболизм железа (адаптировано из Roemhild K. et al., 20213)
Всасывание и транспортировка железа
Роль гепсидина
Железо, поступающее с пищей, поглощается энтероцитами двенадцатиперстной кишки, при этом гемовое и негемовое железо неконкурентно транспортируется разными переносчиками. Fe2+ высвобождается из энтероцитов под действием ферропортина (ФП) и окисляется до Fe3+ для транспортировки в составе трансферрина к местам с высокой потребностью в железе, таким, как костный мозг.
Всасывание и транспортировка железа3
Гепсидин, главный регулятор метаболизма железа, вырабатывается
и секретируется гепатоцитами в зависимости от запасов железа и его уровня
в плазме. Связываясь с ФП, экспрессируемым помимо энтероцитов на гепатоцитах и клетках РЭС, гепсидин инициирует его интернализацию
и деградацию энтероцитами, макрофагами и гепатоцитами, что приводит
к снижению уровня железа в плазме.
Увеличение содержания железа в печени активирует гепсидин, подавляя дальнейшее всасывание железа в кишечнике и его высвобождение из тканевых запасов. И наоборот, повышение эритропоэтической активности, для которой требуется железо, подавляет гепсидин за счет выработки эритроферрона, увеличивая всасывание железа в кишечнике и его экспорт из депо.
Увеличение содержания железа в печени активирует гепсидин, подавляя дальнейшее всасывание железа в кишечнике и его высвобождение из тканевых запасов. И наоборот, повышение эритропоэтической активности, для которой требуется железо, подавляет гепсидин за счет выработки эритроферрона, увеличивая всасывание железа в кишечнике и его экспорт из депо.
Роль гепсидина3
ДЖ у пациентов с ЛАГ, как и при любом другом хроническом заболевании,
может быть:
Патогенез дефицита железа у пациентов с ЛАГ4
Абсолютным: общее количество железа в организме снижено.
В совокупности эти эффекты приводят к относительному истощению запасов железа
в эритроидных клетках и неэритроидных тканях (функциональный пул).


РЭС – ретикулоэндотелиальная система; ФНО – фактор некроза опухолей.

– Снижение поступления железа из-за сердечной кахексии.
– Нарушение всасывания железа в результате отека кишечника и вызванного гепсидином подавления ферропортина.
– Желудочно-кишечные кровопотери, связанные с антитромботической
терапией.
– Нарушение всасывания железа в результате отека кишечника и вызванного гепсидином подавления ферропортина.
– Желудочно-кишечные кровопотери, связанные с антитромботической
терапией.
Функциональным: общее количество железа в организме нормальное или повышенное, но недостаточно для удовлетворения потребностей тканей-мишеней из-за секвестрации в депо (неравномерное распределение железа).
Функциональный ДЖ связан с хроническим воспалением, ассоциированным с ЛАГ:

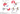
При легочной артериальной гипертензии повышение экспрессии гепсидина
(в том числе в PASMC – гладкомышечных клетках легочных артерий) может индуцироваться воспалительными стимулами не только системно, но и локально,
в тканевых макрофагах, приводя к секвестрации железа за счет связывания ферропортина. Мутации в ферропортине, блокирующие связывание гепсидина, или мутации в рецепторе BMP типа 2 (BMPR2), связанные с ЛАГ и блокирующие продукцию гепсидина, приводят к нерегулируемой активности ферропортина и внутриклеточному дефициту железа в PASMC, что ведет к увеличению эндогенного вазоконстриктора эндотелина-1 и развитию/прогрессированию ЛАГ (Рис. 3).
(в том числе в PASMC – гладкомышечных клетках легочных артерий) может индуцироваться воспалительными стимулами не только системно, но и локально,
в тканевых макрофагах, приводя к секвестрации железа за счет связывания ферропортина. Мутации в ферропортине, блокирующие связывание гепсидина, или мутации в рецепторе BMP типа 2 (BMPR2), связанные с ЛАГ и блокирующие продукцию гепсидина, приводят к нерегулируемой активности ферропортина и внутриклеточному дефициту железа в PASMC, что ведет к увеличению эндогенного вазоконстриктора эндотелина-1 и развитию/прогрессированию ЛАГ (Рис. 3).
Рисунок 3. Связь метаболизма железа с патофизиологией ЛАГ (адаптировано из Babitt J. L., 20195)
Диагностика ДЖ у пациентов с ЛАГ
Согласно текущим рекомендациям по ведению пациентов
с легочной гипертензией Европейского общества кардиологов от 2022, дефицит железа определяется как концентрация ферритина в сыворотке < 100 нг/мл или 100–299 нг/мл с насыщением трансферрина (TSAT) < 20%.

Несколько исследований, проведенных у пациентов с сердечной недостаточностью, поставили под сомнение это определение, так как пациенты с уровнем ферритина < 100 нг/мл, но TSAT > 20% демонстрируют относительно сохраненную физическую работоспособность, функциональное состояние и сниженный ответ на лечение внутривенным карбоксимальтозатом железа6.
В ряде публикаций предлагается определять дефицит железа как уровень TSAT ≤ 21%.
В ряде публикаций предлагается определять дефицит железа как уровень TSAT ≤ 21%.
Так, в своей статье P. Martens et al. (П. Мартенс с соавторами) на основании анализа данных 1028 пациентов с разными вариантами прекапиллярной ЛГ предлагают определять дефицит железа как уровень TSAT ≤ 21% независимо от наличия анемии, демонстрируя лучшую ассоциацию данного порогового значения TSAT с клинико-функциональными показателями, характеризующими тяжесть состояния пациента с ЛГ7.


Лабораторные маркеры обмена железа
(Rifai N. (ed.). Tietz textbook of laboratory medicine, 7th edition. Elsevier, St. Louis, Missouri, 20228)
СЖ отражает концентрацию Fe3+, связанного с трансферрином, и не включает железо, содержащееся в сыворотке крови в виде свободного гемоглобина, ферритина, связанного с альбумином, или в составе низкомолекулярных соединений. Концентрация СЖ снижается при ДЖ и на фоне воспаления (перераспределение железа); концентрация СЖ повышается при гемолитической анемии и перегрузке железом.
СЖ обладает выраженной биологической вариацией. Тест должен назначаться в комбинации с другими маркерами обмена железа для повышения клинической информативности.
СЖ обладает выраженной биологической вариацией. Тест должен назначаться в комбинации с другими маркерами обмена железа для повышения клинической информативности.
Железо сыворотки (СЖ)


Железо в сосудистом русле транспортируется в составе трансферрина (Тф). Тф синтезируется гепатоцитами в соответствии с наличием железа в организме. В ответ на ДЖ его синтез увеличивается, при нормализации содержания железа – снижается.
В норме насыщение трансферрина железом составляет порядка 30%, но может достигать и 100% при перегрузке (например, гемохроматоз).
Тф является негативным острофазовым белком – на фоне воспаления он снижается, в том числе может снижаться на фоне хронических заболеваний.
Тф можно измерить напрямую с помощью иммунологических методов или альтернативно по количеству железа, которое он свяжет (общая железосвязывающая способность сыворотки, ОЖСС). Для этого к исследуемой сыворотке добавляют определенное количество железа до тех пор, пока не будут заполнены все связывающие центры трансферрина. Затем измеряется общее количество железа, связанного с трансферрином, которое характеризует степень нехватки железа сыворотки и отражает количество трансферрина в крови.
Как и Тф, ОЖСС повышается при ДЖ и снижается на фоне воспаления и при перегрузке (например, гемохроматоз).
Тф или ОЖСС должны исследоваться в комбинации с другими маркерами обмена железа для повышения клинической информативности.
В норме насыщение трансферрина железом составляет порядка 30%, но может достигать и 100% при перегрузке (например, гемохроматоз).
Тф является негативным острофазовым белком – на фоне воспаления он снижается, в том числе может снижаться на фоне хронических заболеваний.
Тф можно измерить напрямую с помощью иммунологических методов или альтернативно по количеству железа, которое он свяжет (общая железосвязывающая способность сыворотки, ОЖСС). Для этого к исследуемой сыворотке добавляют определенное количество железа до тех пор, пока не будут заполнены все связывающие центры трансферрина. Затем измеряется общее количество железа, связанного с трансферрином, которое характеризует степень нехватки железа сыворотки и отражает количество трансферрина в крови.
Как и Тф, ОЖСС повышается при ДЖ и снижается на фоне воспаления и при перегрузке (например, гемохроматоз).
Тф или ОЖСС должны исследоваться в комбинации с другими маркерами обмена железа для повышения клинической информативности.
Трансферрин (Тф) и общая железосвязывающая способность сыворотки (ОЖСС)

Отражает долю (%) трансферрина, связанного с железом, и служит маркером доступности циркулирующего железа для обеспечения им клеток.
Формулы для расчета:
НТЖ = СЖ/ОЖСС × 100 или
НТЖ = СЖ (мкмоль/л)/(Тф [г/л]×25,2)×100.
В случае абсолютного ДЖ концентрация Тф увеличивается, а СЖ падает – как следствие, НТЖ снижается. НТЖ является более чувствительным маркером ДЖ, чем определение концентрации одного Тф.
Необходимо иметь в виду, что при воспалительных процессах концентрация Тф и СЖ может снижаться, а НТЖ не изменяется, что делает данный тест информативным маркером ДЖ при хронических заболеваниях.
Формулы для расчета:
НТЖ = СЖ/ОЖСС × 100 или
НТЖ = СЖ (мкмоль/л)/(Тф [г/л]×25,2)×100.
В случае абсолютного ДЖ концентрация Тф увеличивается, а СЖ падает – как следствие, НТЖ снижается. НТЖ является более чувствительным маркером ДЖ, чем определение концентрации одного Тф.
Необходимо иметь в виду, что при воспалительных процессах концентрация Тф и СЖ может снижаться, а НТЖ не изменяется, что делает данный тест информативным маркером ДЖ при хронических заболеваниях.
Насыщение трасферрина железом (НТЖ)

СФ секретируется тканями, запасающими железо, и отражает уровень ферритина
(депо железа) в тканях. В условиях воспаления СФ ведет себя как белок острой фазы,
и вследствие этого может давать повышение уровня в отсутствие каких-либо изменений
общих запасов железа в организме. Концентрация СФ возрастает при заболеваниях печени и неопластических процессах.
При хронических воспалительных состояниях повышение уровня гепсидина приводит к секвестрации железа в макрофагах. Отмечается нормальный или даже высокий уровень СФ, несмотря на снижение доступности железа для эритропоэза, что затрудняет интерпретацию его результатов. Чтобы учесть это влияние, предлагается использовать иные, чем для пациентов без хронического воспаления, пороговые значения для выявления ДЖ, однако здесь существует значительная вариабельность рекомендаций (< 50, < 100 или < 200 мкг/л).
При хронических воспалительных состояниях повышение уровня гепсидина приводит к секвестрации железа в макрофагах. Отмечается нормальный или даже высокий уровень СФ, несмотря на снижение доступности железа для эритропоэза, что затрудняет интерпретацию его результатов. Чтобы учесть это влияние, предлагается использовать иные, чем для пациентов без хронического воспаления, пороговые значения для выявления ДЖ, однако здесь существует значительная вариабельность рекомендаций (< 50, < 100 или < 200 мкг/л).
Ферритин сыворотки (СФ)


Распространенность ДЖ и его влияние на тяжесть ЛАГ и прогноз больных
В ранних сравнительных исследованиях у пациентов с ЛГ, где по факту оценивалась распространенность абсолютного железодефицита (определялся авторами как уровень ферритина менее 10 мкг/л) было показано, что среди пациентов с ЛАГ она выше. Так, в работе британских авторов, включающей 270 пациентов с ЛАГ и ХТЭЛГ за период 1998–2008 гг. у пациентов с ЛАГ ДЖ встречался чаще – 30,1% против 4,9% у больных с ХТЭЛГ, при том что группы не отличались по тяжести течения, частоте приема антикоагулянтов и использования антагонистов рецепторов эндотелина* (факторы, потенциально влияющие на обмен железа). Отличия сохранялись при делении пациентов по возрасту (Рис. 3). При анализе подгруппы ИЛАГ пациенты с дефицитом железа были моложе (р = 0,02) и несколько чаще принимали антагонисты рецепторов эндотелина (р = 0,09)9.
* Антагонисты рецепторов эндотелина не зарегистрированы в РФ для применения при ХТЭЛГ.
Рисунок 4. Распространенность железодефицита у пациентов с ИЛАГ и ХТЭЛГ (адаптировано из Soon E. et al., 20119)
ИЛАГ – идиопатическая легочная артериальная гипертензия;
ХТЭЛГ – хроническая тромбоэмболическая легочная гипертензия.
ХТЭЛГ – хроническая тромбоэмболическая легочная гипертензия.
В процессе достижения компенсации ЛАГ на фоне специфической терапии частота встречаемости и степень ДЖ могут снижаться: так, в исследовании среди впервые выявленных больных с ЛАГ частота ДЖ (определялся авторами как уровень ферритина менее 10 мкг/л) составила 42% и снизилась до 29% на фоне 18 месяцев применения ЛАГ-терапии. При этом уровень железа положительно коррелировал со значением дистанции в тесте 6-минутной ходьбы10.
Данные отечественного исследования, посвященного оценке частоты ДЖ у пациентов с ЛАГ (n = 20, 44 [32–60] лет) и ХТЭЛГ (n = 51, 56,0 [44,0–67,0] лет), согласуются
с международными результатами – ДЖ был более распространен в группе ЛАГ,
но его частота значительно менялась в обеих группах в зависимости от применяемых критериев11 (Рис. 5).
с международными результатами – ДЖ был более распространен в группе ЛАГ,
но его частота значительно менялась в обеих группах в зависимости от применяемых критериев11 (Рис. 5).
Рисунок 5. Распространенность анемии у пациентов с ЛАГ и ХТЭЛГ в соответствии с различными критериями (адаптировано из: Ю. И. Жиленкова, М. А. Симакова
и др., 202311)
и др., 202311)
Примечание: ДЖ1 – СФ < 30 мкг/л; ДЖ2 – СФ < 100 мкг/л; ДЖ3 – НТЖ < 20%; ДЖ4 – СФ < 100 или < 299 мкг/л при НТЖ < 20%.
ИЛАГ – идиопатическая легочная артериальная гипертензия; ХТЭЛГ – хроническая тромбоэмболическая легочная гипертензия; СФ – ферритин сыворотки; НТЖ – насыщение трансферрина железом.
ИЛАГ – идиопатическая легочная артериальная гипертензия; ХТЭЛГ – хроническая тромбоэмболическая легочная гипертензия; СФ – ферритин сыворотки; НТЖ – насыщение трансферрина железом.

Влияние ЛАГ-специфической терапии на риск ЖД и анемии
В инструкциях большинства ЛАГ-специфических препаратов (бозентан, мацитентан, амбризентан, силденафил, риоцигуат, селексипаг) упоминается возможность развития анемии как частого нежелательного явления. Особую настороженность в этом отношении вызывают антагонисты рецепторов эндотелина (АРЭ). Российские клинические рекомендации содержат указание на необходимость обязательного контроля уровня гемоглобина на фоне лечения АРЭ12,13.
Рекомендуется контроль уровней гемоглобина и гематокрита крови у пациентов с ЛАГ, получающих АРЭ12.
- ЕОК нет (УУР С, УДД 5)
Всем пациентам с ЛАГ, получающим лечение антагонистами рецепторов эндотелина, рекомендуется ежемесячное определение уровня гемоглобина в крови для оценки безопасности терапии (I C)13.
Увеличение риска развития анемии на фоне терапии АРЭ в сравнении с плацебо было подтверждено в обзоре клинических исследований14 и двух мета-анализах15,16. Механизмы развития данного нежелательного явления остаются неясными15. Анемия в исследованиях АРЭ чаще всего была легкой, но в отдельных случаях требовала гемотрансфузии17.
В исследованиях комбинированной терапии, включавшей АРЭ, анемия развивалась чаще при применении комбинации по сравнению с группами монотерапии или плацебо (Рис. 6). При этом абсолютное большинство пациентов получали комбинацию АРЭ и ингибиторов фосфодиэстеразы 5-го типа (иФДЭ-5).
В исследованиях комбинированной терапии, включавшей АРЭ, анемия развивалась чаще при применении комбинации по сравнению с группами монотерапии или плацебо (Рис. 6). При этом абсолютное большинство пациентов получали комбинацию АРЭ и ингибиторов фосфодиэстеразы 5-го типа (иФДЭ-5).
Подробнее
А – амбризентан; Б – бозентан; М – мацитентан; Пл – плацебо; С – силденафил; Т – тадалафил;
М/Т – фиксированная комбинация мацитентана и тадалафила.
М/Т – фиксированная комбинация мацитентана и тадалафила.
* Анализ данных пациентов, исходно получавших ЛАГ-специфическую терапию
(иФДЭ-5 – 97,4%) и рандомизированных в группы мацитентана 10 мг 1 р/день или плацебо.
Комбинация АРЭ с иФДЭ-5 обладает доказанной эффективностью при стартовой и последовательной терапии и широко применяется в реальной клинической практике для лечения пациентов с ЛАГ. При развитии клинически значимого нежелательного эффекта и невозможности продолжения терапии рекомендуется переключение с одного препарата на другой в рамках того же класса ЛАГ-специфической терапии или на лекарственный препарат другого класса13. Учитывая, что снижение уровня гемоглобина представляется класс-специфическим эффектом АРЭ, при развитии анемии у пациентов, получающих комбинацию АРЭ иФДЭ-5, замена АРЭ на препарат, воздействующий на путь простациклина (например, селексипаг) может быть альтернативным вариантом лечения.
Целью лечения железодефицитных состояний является введение железа в количестве, необходимом для нормализации уровня гемоглобина
(у женщин 120–140 г/л, у мужчин 130–160 г/л) и восполнения тканевых запасов железа (ферритин сыворотки у пациентов с сердечной недостаточностью – более 100 мкг/л). В соответствии с рекомендацией ВОЗ оптимальная доза железа для лечения ЖДА составляет 100–120 мг в день, для профилактики железодефицита – 60 мг в день22.
(у женщин 120–140 г/л, у мужчин 130–160 г/л) и восполнения тканевых запасов железа (ферритин сыворотки у пациентов с сердечной недостаточностью – более 100 мкг/л). В соответствии с рекомендацией ВОЗ оптимальная доза железа для лечения ЖДА составляет 100–120 мг в день, для профилактики железодефицита – 60 мг в день22.
Коррекция железодефицитных состояний


При назначении пероральных препаратов железа с целью коррекции ДЖ надо учитывать большую эффективность препаратов двухвалентного железа и лучшую переносимость препаратов трехвалентного железа при их меньшей биодоступности. Прием перорального железа реже (например, через день) может дополнительно улучшить абсорбцию и снизить побочные эффекты со стороны ЖКТ. Кроме того, новые пероральные препараты с улучшенной биодоступностью, такие как феррум мальтол и сукросомальное железо продемонстрировали в пилотных исследованиях возможные клинические преимущества, включая улучшение физической выносливости у пациентов с сердечной недостаточностью. Так, в работе Olsson et al. продемонстрирована эффективность железо-мальтозного комплекса у пациентов с ЛАГ в виде значимого улучшения показателей обмена железа, прироста дистанции в ТШХ и снижения уровня натрийуретического пептида23.
Следует помнить о необходимости длительного приема пероральных препаратов железа (не менее 12–16 недель) для достижения значимого клинического результата.
При необходимости быстрой коррекции ДЖ, при непереносимости пероральных препаратов, а также у пациентов с высоким ФК ЛАГ следует рассматривать применение внутривенных форм препаратов железа, в отношении которых имеется большая доказательная база у больных с ХСН. Исследования у пациентов с ЛАГ и ХТЭЛГ малочисленны и имеют разный дизайн, что затрудняет их обобщенную интерпретацию. Так, по данным Howard et al., у пациентов с ИЛАГ и наследственной ЛАГ и наличием ДЖ применение карбоксимальтозата железа сопровождалось статистически значимым улучшением лабораторных показателей обмена железа без улучшения параметров гемодинамики малого круга кровообращения и дистанции в ТШХ24. При этом в сравнительном исследовании Kramer Т. et al. с включением 58 пациентов с ЛАГ, получавших специфическую терапию и имевших критерии ДЖ (согласно текущим рекомендациям ESC/ERS, 202225), его коррекция с помощью внутривенного введения карбоксимальтозата железа (однократное введение 500 или 1000 мг препарата) привела к устойчивому улучшению показателей обмена железа (уровень сывороточного железа, ферритина, насыщение трансферрина) на протяжении наблюдения до 18 месяцев (р < 0,01). Отмечалось увеличение дистанции шестиминутной ходьбы: с 377,5 ± 15,9 метров исходно до 412,5 ± 15,1 метров (р < 0,05) через 6 месяцев и 400,8 ± 14,5 метров (p < 0,05) через 18 месяцев наблюдения. Также продемонстрировано уменьшение числа госпитализаций по причине ухудшения ЛАГ в течение 12 месяцев после коррекции дефицита железа (р = 0,029)26. Таким образом, на сегодняшний день получены первые данные о позитивном влиянии коррекции ДЖ на функциональный статус больных с ЛАГ.


Заключение
– Все пациенты с ЛАГ относятся к группе риска в отношении
железодефицитных состояний, что требует периодического контроля в виде клинического анализа крови, определение уровня ферритина сыворотки и НТЖ.
– Недавние исследования говорят о прямой причинно-следственной связи между дефицитом железа в гладкомышечных клетках легочной артерии и прогрессировании ЛАГ.
– Критически важна верификация железодефицитного состояния (латентный дефицит железа или анемия) и идентификация их причины до начала терапии.
– При проведении терапии, включающей агонисты рецепторов эндотелина, необходим регулярный контроль уровня гемоглобина.
– Лечение железодефицитных состояний должно быть индивидуальным в соответствии с этиологией и тяжестью дефицита железа.
– Пероральные препараты железа менее эффективны у пациентов с ЛАГ, особенно в случае декомпенсации СН. В данной категории пациентов с целью улучшения симптомов СН и функциональных возможностей рекомендовано использование внутривенных форм препаратов железа.
– Требуются дальнейшие исследования для уточнения оптимальных критериев ДЖ, а также группы риска в зависимости от этиологии легочной гипертензии и уровней экспрессии гепсидина.
– Необходимы крупные рандомизированные контролируемые исследования с использованием легко усваиваемого перорального или внутривенного железа у пациентов с железодефицитными состояниями, чтобы изучить их потенциальную пользу у пациентов с ЛАГ, а также разработать меры первичной профилактики.
Литература
1. Cappellini M. D. et al. Iron deficiency across chronic inflammatory conditions: International expert opinion on definition, diagnosis, and management. American J Hematol. 2017; 92(10): 1068–1078.
2. Melenovsky V. et al. Myocardial iron content and mitochondrial function in human heart failure: a direct tissue analysis. European J of Heart Fail. 2017; 19(4): 522–530.
3. Roemhild K. et al. Iron metabolism: pathophysiology and pharmacology. Trends in Pharmacological Sciences. 2021; 42: 640–656.
4. Anand I. S., Gupta P. Anemia and Iron Deficiency in Heart Failure: Current Concepts and Emerging Therapies. Circulation. 2018; 138(1): 80–98.
5. Babitt J. L. Ironing out pulmonary arterial hypertension. PNAS. 2019; 116 (26): 12604-12606.
6. Anker S. D. et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis. Eur J Heart Fail. 2018; 20: 125–133.
7. Martens P. et al., the PVDOMICS Study Group. Iron deficiency in pulmonary vascular disease: pathophysiological and clinical implications. European Heart Journal. 2023; 44(22): 1979–1991.
8. Rifai N. (ed.). Tietz textbook of laboratory medicine, Seventh edition. Elsevier, St. Louis, Missouri, 2022.
9. Soon E. et al. Unexplained iron deficiency in idiopathic and heritable pulmonary arterial hypertension Thorax. 2011 Apr; 66(4): 326-332.
10. Vinke P. et al. Prevalence of Micronutrient Deficiencies and Relationship with Clinical and Patient-Related Outcomes in Pulmonary Hypertension Types I and IV. Nutrients. 2021; 13: 3923.
11. Жиленкова Ю. И., Симакова М. А. и др. Исследование обмена железа у пациентов с легочной артериальной гипертензией и хронической тромбоэмболической легочной гипертензией. Тезисы XI Всероссийского конгресса «Легочная гипертензия–2023», 14–15.12.2023. Системные гипертензии. 2023; 20(4): 41.
12. Авдеев С. Н. и др. Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Клинические рекомендации, 2020. Российский кардиологический журнал. 2021; 26(12): 4683.
13. Чазова И. Е. и др. Евразийские рекомендации по диагностике и лечению легочной гипертензии (2023). Евразийский Кардиологический Журнал. 2024; (1): 6-85.
14. Aversa M., Porter S., Granton J. Comparative safety and tolerability of endothelin receptor antagonists in pulmonary arterial hypertension. Drug Saf. 2015; 38: 419–435.
15. Wei A. et al. Clinical Adverse Effects of Endothelin Receptor Antagonists: Insights From the Meta-Analysis of 4894 Patients From 24 Randomized Double-Blind Placebo-Controlled Clinical Trials. J Am Heart Assoc. 2016; 5: e003896.
16. Zhang Y-J. et al. A network meta-analysis for safety of endothelin receptor antagonists in pulmonary arterial hypertension. Cardiovasc Diagn Ther. 2019; 9(3): 239–249.
17. Simonneau G. et al. Long-term results from the EARLY study of bosentan in WHO functional class II pulmonary arterial hypertension patients. Int J Cardiol. 2014; 172(2): 332–339.
18. McLaughlin V. et. al. Bosentan added to sildenafil therapy in patients with pulmonary arterial hypertension. Eur Respir J. 2015; 46(2): 405–413.
19. Jansa P., Pulido T. Macitentan in Pulmonary Arterial Hypertension: A Focus on Combination Therapy in the SERAPHIN Trial. Am J Cardiovasc Drugs. 2018; 18: 1–11.
20. Galiè N. et al. Initial Use of Ambrisentan plus Tadalafil in Pulmonary Arterial Hypertension. N Engl J Med. 2015; 373(9): 834–844.
21. Grünig E. et al. Randomized trial of macitentan/tadalafil single-tablet combination therapy for pulmonary arterial hypertension. J Am Coll Cardiol. 2024; 83: 473–484.
22. Железодефицитная анемия. Клинические рекомендации Минздрава РФ, 2021 г. https://npngo.ru/biblioteka/klinicheskie_rekomendatsii__2021_god_
23. Olsson K. M. et al. Oral iron supplementation with ferric maltol in patients with pulmonary hypertension. Eur Respir J. 2020; 56(5): 2000616.
24. Howard L. S. G. E. et al. Supplementation with iron in pulmonary arterial hypertension. two randomized crossover trials. Ann Am Thorac Soc. 2021; 18(6): 981–988.
25. Humbert M. et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J. 2022; 43: 3618–3731.
26. Kramer T. et al. Ferric carboxymaltose in patients with pulmonary arterial hypertension and iron deficiency: a long-term study. Journal of Cachexia, Sarcopenia and Muscle. 2021; 12(5): 1501–1512.
2. Melenovsky V. et al. Myocardial iron content and mitochondrial function in human heart failure: a direct tissue analysis. European J of Heart Fail. 2017; 19(4): 522–530.
3. Roemhild K. et al. Iron metabolism: pathophysiology and pharmacology. Trends in Pharmacological Sciences. 2021; 42: 640–656.
4. Anand I. S., Gupta P. Anemia and Iron Deficiency in Heart Failure: Current Concepts and Emerging Therapies. Circulation. 2018; 138(1): 80–98.
5. Babitt J. L. Ironing out pulmonary arterial hypertension. PNAS. 2019; 116 (26): 12604-12606.
6. Anker S. D. et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis. Eur J Heart Fail. 2018; 20: 125–133.
7. Martens P. et al., the PVDOMICS Study Group. Iron deficiency in pulmonary vascular disease: pathophysiological and clinical implications. European Heart Journal. 2023; 44(22): 1979–1991.
8. Rifai N. (ed.). Tietz textbook of laboratory medicine, Seventh edition. Elsevier, St. Louis, Missouri, 2022.
9. Soon E. et al. Unexplained iron deficiency in idiopathic and heritable pulmonary arterial hypertension Thorax. 2011 Apr; 66(4): 326-332.
10. Vinke P. et al. Prevalence of Micronutrient Deficiencies and Relationship with Clinical and Patient-Related Outcomes in Pulmonary Hypertension Types I and IV. Nutrients. 2021; 13: 3923.
11. Жиленкова Ю. И., Симакова М. А. и др. Исследование обмена железа у пациентов с легочной артериальной гипертензией и хронической тромбоэмболической легочной гипертензией. Тезисы XI Всероссийского конгресса «Легочная гипертензия–2023», 14–15.12.2023. Системные гипертензии. 2023; 20(4): 41.
12. Авдеев С. Н. и др. Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Клинические рекомендации, 2020. Российский кардиологический журнал. 2021; 26(12): 4683.
13. Чазова И. Е. и др. Евразийские рекомендации по диагностике и лечению легочной гипертензии (2023). Евразийский Кардиологический Журнал. 2024; (1): 6-85.
14. Aversa M., Porter S., Granton J. Comparative safety and tolerability of endothelin receptor antagonists in pulmonary arterial hypertension. Drug Saf. 2015; 38: 419–435.
15. Wei A. et al. Clinical Adverse Effects of Endothelin Receptor Antagonists: Insights From the Meta-Analysis of 4894 Patients From 24 Randomized Double-Blind Placebo-Controlled Clinical Trials. J Am Heart Assoc. 2016; 5: e003896.
16. Zhang Y-J. et al. A network meta-analysis for safety of endothelin receptor antagonists in pulmonary arterial hypertension. Cardiovasc Diagn Ther. 2019; 9(3): 239–249.
17. Simonneau G. et al. Long-term results from the EARLY study of bosentan in WHO functional class II pulmonary arterial hypertension patients. Int J Cardiol. 2014; 172(2): 332–339.
18. McLaughlin V. et. al. Bosentan added to sildenafil therapy in patients with pulmonary arterial hypertension. Eur Respir J. 2015; 46(2): 405–413.
19. Jansa P., Pulido T. Macitentan in Pulmonary Arterial Hypertension: A Focus on Combination Therapy in the SERAPHIN Trial. Am J Cardiovasc Drugs. 2018; 18: 1–11.
20. Galiè N. et al. Initial Use of Ambrisentan plus Tadalafil in Pulmonary Arterial Hypertension. N Engl J Med. 2015; 373(9): 834–844.
21. Grünig E. et al. Randomized trial of macitentan/tadalafil single-tablet combination therapy for pulmonary arterial hypertension. J Am Coll Cardiol. 2024; 83: 473–484.
22. Железодефицитная анемия. Клинические рекомендации Минздрава РФ, 2021 г. https://npngo.ru/biblioteka/klinicheskie_rekomendatsii__2021_god_
23. Olsson K. M. et al. Oral iron supplementation with ferric maltol in patients with pulmonary hypertension. Eur Respir J. 2020; 56(5): 2000616.
24. Howard L. S. G. E. et al. Supplementation with iron in pulmonary arterial hypertension. two randomized crossover trials. Ann Am Thorac Soc. 2021; 18(6): 981–988.
25. Humbert M. et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J. 2022; 43: 3618–3731.
26. Kramer T. et al. Ferric carboxymaltose in patients with pulmonary arterial hypertension and iron deficiency: a long-term study. Journal of Cachexia, Sarcopenia and Muscle. 2021; 12(5): 1501–1512.
Продолжить чтение
Материал предназначен исключительно для медицинских и фармацевтических работников.
СР-469312, октябрь 2024.
ООО "Джонсон & Джонсон", 121614, Москва, ул. Крылатская, д.17, корп. 2.
тел.: +7 (495) 755-83-57, факс: +7 (495) 755-83-58.
СР-469312, октябрь 2024.
ООО "Джонсон & Джонсон", 121614, Москва, ул. Крылатская, д.17, корп. 2.
тел.: +7 (495) 755-83-57, факс: +7 (495) 755-83-58.