В современной клинической классификации легочной гипертензии (ЛГ) легочная артериальная гипертензия (ЛАГ) выделена в отдельную группу I, поскольку, несмотря
на различную этиологию, ЛАГ имеет общие патоморфологические, патофизиологические черты и схожие подходы в применении ЛАГ-специфической терапии.
на различную этиологию, ЛАГ имеет общие патоморфологические, патофизиологические черты и схожие подходы в применении ЛАГ-специфической терапии.
Систематический анализ литературы (2003–2020):




ЛАГ у взрослых1



*В систематических национальных регистрах показатели заболеваемости ЛАГ более низкие , что обусловлено включением пациентов в регистр на основании тщательного обследования с обязательным выполнением катетеризации правых камер сердца. Вариабельность данных о заболеваемости и распространенности в мире во многом связана с уровнем организации систем здравоохранения отдельных стран, административным инспектированием сети референтных центров ЛАГ, региональными и этническими особенностями. Улучшение информированности врачей о проблеме ЛГ и широкое внедрение 5 классов ЛАГ-специфических препаратов привело к увеличению выживаемости пациентов ЛАГ и, соответственно, к повышению распространенности ЛАГ за последнее десятилетие.



Для регистров стран Азии и Африки характерны2:
более молодая популяция пациентов ЛАГ
(45 против 52,7 лет);
(45 против 52,7 лет);

большее число женщин (72% против 66,6%);
меньшая доля ИЛАГ в структуре ЛАГ (36% против 55%);
более высокая распространенность ЛАГ, ассоциированной с ВПС (23% против 12%), ВИЧ-инфекцией по сравнению
с регистрами экономически развитых западных стран.
с регистрами экономически развитых западных стран.
Для стран Африки эндемична ЛАГ, обусловленная шистосомозом3.
Идиопатическая легочная артериальная
гипертензия (ИЛАГ)
гипертензия (ИЛАГ)
В большинстве регистров ЛАГ доминируют пациенты
с ИЛАГ (50–60 % всех случаев).
с ИЛАГ (50–60 % всех случаев).
Такое изменение демографической картины ЛАГ в регистрах Западной Европы связано с большим количеством референтных центров и высоким уровнем здравоохранения в целом, делающим доступным весь спектр диагностических исследований.
Постановка диагноза ИЛАГ требует исключения любых других причин, ассоциированных с повышением срДЛА и ЛСС.
Традиционно классические пациенты с ИЛАГ – женщины 30-40 лет
без значимой сердечно-легочной патологии (соотношение мужчин и женщин 1:2.8-4.8)4.
без значимой сердечно-легочной патологии (соотношение мужчин и женщин 1:2.8-4.8)4.
Начиная с первого регистра ЛГ в 1987, средний возраст пациентов с ИЛАГ увеличился с 36 лет до 65-67 лет в Европейских регистрах5.
Вместе с повышением возраста возросло количество пациентов с сердечно-сосудистой патологией и лиц мужского пола, которые зачастую имеют длительный стаж курения и сопутствующую патологию легких6.
Популяция вазореспондеров7
Пациентам с идиопатической, наследственной и лекарственной ЛАГ II-III ФК (ВОЗ) при катетеризации правых отделов сердца выполняется вазореактивный тест.
Положительный тест позволяет назначить пациенту терапию блокаторами кальциевых каналов (БКК).
Длительные вазореспондеры, способные достигать и удерживать категорию низкого риска летальности на фоне терапии БКК более 12 месяцев, имеют самую высокую выживаемость среди всех нозологий ЛАГ (группа I):

Однако эта популяция очень немногочисленна:

С каждым годом идентифицируют все больше генов, ассоциированных
с развитием ЛАГ. Мутация гена BMPR2 наиболее распространена у пациентов с ИЛАГ и хорошо изучена.
с развитием ЛАГ. Мутация гена BMPR2 наиболее распространена у пациентов с ИЛАГ и хорошо изучена.
Наследственная легочная артериальная
гипертензия
гипертензия
Истинную распространенность наследственной ЛАГ оценить крайне сложно в связи с ограниченной доступностью генетического тестирования.
По данным Badlam JB и соавт. (2021), после выполнения генетического исследования доля пациентов, исходно трактуемых как ИЛАГ, с 44% сократилась до 36%, а доля пациентов с наследственной ЛАГ составила 15% (включая 4% пациентов с исходным диагнозом семейной ЛАГ)10.
Семейные случаи регистрируются среди

пациентов с ИЛАГ8.
Гетерозиготная мутация в гене BMPR2 встречается9:


пациентов с семейной ИЛАГ
спорадических случаях ИЛАГ
ЛАГ с признаками вовлечения
вен/капилляров
вен/капилляров
Общие факторы риска, генетическая основа и неотличимые клинические проявления легочной веноокклюзионной болезни (ЛВОБ) и легочного капиллярного гемангиоматоза (ЛКГ) позволяют рассматривать данные заболевания как единое патологическое состояние, принадлежащее к спектру заболеваний ЛАГ (ЛАГ с признаками вовлечения вен/капилляров)11.
ЛВОБ/ЛКГ — крайне редкое заболевание, характеризующееся вовлечением в патологический процесс венул легких.
Заболеваемость ЛВОБ/ЛКГ



Семейные формы ЛВОБ/ЛКГ обычно встречаются у молодых сиблингов одного поколения, иногда не затрагивая генетически родственных родителей, и это указывает на то, что заболевание передается как рецессивный признак. Биаллельные мутации в гене EIF2AK4 приводят к развитию наследственной формы ЛВОБ/ЛКГ12,13.
Учитывая сложность постановки диагноза ЛВОБ/ЛКГ, около 12% пациентов первоначально имеют диагноз ИЛАГ14.

лекарственные препараты (митомицин С, циклофосфамид);

контакт с органическими растворителями (трихлорэтилен);

системные заболевания соединительной ткани (системная склеродермия);

ВИЧ-инфекцию.
В отличие от ИЛАГ, ЛВОБ/ЛКГ чаще наблюдается
у мужчин- курильщиков и характеризуется:
у мужчин- курильщиков и характеризуется:
самой высокой летальностью в структуре ЛАГ с 3-х летней выживаемостью 34%;
высоким риском развития отека легких на фоне применения ЛАГ- специфической терапии (23% пациентов)14.


Существуют заболевания, при которых достоверно чаще регистрируются случаи ЛАГ. Такие заболевания называются ассоциированными с ЛАГ.
Ассоциированная ЛАГ
К ним относятся:




системные заболевания соединительной ткани (СЗСТ);
врожденные пороки сердца (ВПС) с артерио-венозным сообщением и обогащением легочного кровотока;
ВИЧ-инфекция;
патология печени;
прием определенных лекарств/токсинов;
шистосомоз.


В структуре ЛАГ ассоциированная ЛАГ занимает около 50%.
ЛАГ, ассоциированная с системными
заболеваниями соединительной ткани (СЗСТ)
заболеваниями соединительной ткани (СЗСТ)
По данным наиболее крупных регистров Европы и Америки, доля ЛАГ, ассоциированной с СЗСТ, составляет до 31% среди всех пациентов ЛАГ, причем системная склеродермия (ССД), преимущественно лимитированный вариант, является основной причиной.




В странах Азии, напротив, системная красная волчанка наиболее часто регистрируется у пациентов с ЛАГ, однако в данном случае, необходимо всегда тщательно исключать хроническую тромбоэмболическую легочную гипертензию (ХТЭЛГ)3.
Связь между ревматоидным артритом и развитием ЛАГ не установлена.
У пациентов с ССД могут встречаться разные варианты ЛГ, поэтому определение ведущего клинического фенотипа
и гемодинамического варианта крайне важно для выбора оптимальной стратегии лечения22.
и гемодинамического варианта крайне важно для выбора оптимальной стратегии лечения22.
Реже ЛАГ обнаруживают у пациентов16:
смешанными СЗСТ;
с болезнью Шегрена;
дерматомиозитом (в крайне редких случаях).





Эпидемиология ЛАГ-ССД
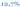
Легочная артериальная гипертензия, ассоциированная с ВИЧ-инфекцией
Распространенность ЛАГ, верифицированной при КПКС, у пациентов с ВИЧ- инфекцией составляет

Это в

раз выше по сравнению с популяцией людей
без ВИЧ-инфекции23.
В странах Африки распространенность ЛАГ в популяции людей, живущих с ВИЧ, достигает
24.
Однако такая высокая распространенность может быть обусловлена не только большим количеством пациентов с ВИЧ в целом, но и возможным вкладом:




шистосомоза;
патологии печени;
проживания части больных в высокогорных районах;
употребления запрещенных препаратов;
включением в регистр на основании ЭхоКГ.

Клинические и патоморфологические изменения при ЛАГ, ассоциированной с ВИЧ-инфекцией (ЛАГ-ВИЧ), имеют много общего с ИЛАГ.
Какой-либо корреляции между возникновением ЛАГ и стадией ВИЧ- инфекции или степенью иммунодефицита не выявлено25.
Факторами риска развития ЛАГ у пациентов с ВИЧ-инфекцией являются:
женский пол
внутривенное применение запрещенных препаратов
хронический гепатит С
Портопульмональная легочная гипертензия (ППЛГ)
2–6%
всех пациентов
с портальной гипертензией3
с портальной гипертензией3
В редких случаях у пациентов с ППЛГ имеются портосистемные шунты при отсутствии портальной гипертензии (врожденные внепеченочные портокавальные шунты).
5–8,5%
пациентов, имеющих показания к трансплантации печени26
5–15%
доля в регистрах ЛАГ3
Легочная артериальная гипертензия, ассоциированная с применением лекарственных препаратов и токсинов
Применение некоторых лекарственных препаратов и токсинов ассоциировано с развитием ЛАГ или ЛВОБ/ЛКГ.
Ранее наиболее яркими примерами являлись27:
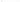
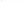
В настоящее время более распространенными причинами являются27:
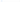
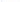

ЛАГ, ассоциированная с применением метамфетаминов, зарегистрирована у 20– 29% пациентов с первоначальным диагнозом ИЛАГ в регистрах США. У пациентов с ЛАГ, ассоциированной с применением метамфетаминов, регистрировались более серьезные нарушения гемодинамики и более высокий риск летального исхода по сравнению с пациентами с ИЛАГ. Применение альфа- и бета-интерферонов также ассоциировалось с развитием ЛАГ28.
некоторые препараты для подавления аппетита;
токсичное рапсовое масло.
метамфетамины;
интерфероны;
некоторые ингибиторы тирозинкиназы, такие как дазатиниб, босутиниб и понатиниб.
ЛАГ, ассоциированная с врожденными пороками сердца
У пациентов с ВПС могут возникать различные гемодинамические варианты ЛГ в зависимости от анатомии порока. Но прекапиллярная ЛГ развивается преимущественно у пациентов с ВПС с хронической перегрузкой малого круга кровообращения большим объемом крови, что наблюдается при наличии артерио-венозного шунта.
Примерно у 3–7 % взрослых пациентов с ВПС с артериовенозными шунтами развивается ЛАГ.
Частота развития ЛАГ зависит от характера дефекта и сложности ВПС.
ЛАГ ассоциирована с женским полом.
Заболеваемость ЛАГ увеличивается с возрастом.
У пациентов с корригированным ВПС развитие ЛАГ зависит от возраста коррекции и наличия повышенного давления в легочной артерии на момент выполнения вмешательства29.
Распространенность ЛАГ у пациентов после коррекции простого порока сердца составляет 3 %30.



Благодаря достижениям в диагностической и терапевтической детской кардиологии ожидается изменение эпидемиологических характеристик ЛАГ, ассоциированной с ВПС, у взрослых. Вероятно, будет меньше взрослых пациентов с простыми ВПС и больше пациентов со сложными поражениями и (или) с закрытыми дефектами, у которых ЛАГ развивается во взрослом возрасте.
Выделяют 4 клинических варианта течения ЛАГ, ассоциированной с ВПС31
Включает все крупные внутри- и внесердечные шунты, с реверсией шунта (право-левый) или двунаправленным шунтированием крови. Сопровождается развитием высокой легочной артериальной гипертензией, цианозом, вторичным эритроцитозом и полиорганными нарушениями. Закрытие дефектов противопоказано.
Включает средние и крупные дефекты. ЛСС слегка или умеренно повышено; превалирует системно-легочное направление шунта; цианоз в покое и при физической нагрузке отсутствует. Перспективы оперативного лечения определяются в индивидуальном порядке в референтном центре ЛГ.
Выраженное повышение ЛСС при наличии пороков сердца, которые с точки зрения гемодинамики считаются незначимыми (обычно эффективный диаметр по данным эхокардиографии дефекта межжелудочковой перегородки <1 см и дефекта межпредсердной перегородки <2 см), которые сами по себе не являются причиной повышенного ЛСС. Клиническая картина очень сходна с ИЛАГ. Закрытие дефектов противопоказано.
Несмотря на коррекцию врожденного порока сердца, ЛАГ сохраняется сразу же после вмешательства или рецидивирует/развивается спустя месяцы и годы после коррекции.
Включает все крупные внутри- и внесердечные шунты, с реверсией шунта (право-левый) или двунаправленным шунтированием крови. Сопровождается развитием высокой легочной артериальной гипертензией, цианозом, вторичным эритроцитозом и полиорганными нарушениями. Закрытие дефектов противопоказано.
Включает средние и крупные дефекты. ЛСС слегка или умеренно повышено; превалирует системно-легочное направление шунта; цианоз в покое и при физической нагрузке отсутствует. Перспективы оперативного лечения определяются в индивидуальном порядке в референтном центре ЛГ.
Выраженное повышение ЛСС при наличии пороков сердца, которые с точки зрения гемодинамики считаются незначимыми (обычно эффективный диаметр по данным эхокардиографии дефекта межжелудочковой перегородки <1 см и дефекта межпредсердной перегородки <2 см), которые сами по себе не являются причиной повышенного ЛСС. Клиническая картина очень сходна с ИЛАГ. Закрытие дефектов противопоказано.
Несмотря на коррекцию врожденного порока сердца, ЛАГ сохраняется сразу же после вмешательства или рецидивирует/развивается спустя месяцы и годы после коррекции.
Среди всех клинических групп ЛАГ, ассоциированной с ВПС, наилучшие показатели выживаемости отмечаются среди пациентов с синдромом Эйзенменгера, а наихудшие — у пациентов с ЛАГ и мелкими дефектами и ЛАГ, ассоциированной с корригированным ВПС32.
Выживаемость пациентов с ЛАГ-ВПС в зависимости от клинических групп32
Легочная артериальная гипертензия, ассоциированная с шистосомозом
Шистосомоз — одно из наиболее распространенных хронических инфекционных заболеваний во всем мире, которым страдает
По сравнению с пациентами с ИЛАГ, у пациентов с ЛАГ, ассоциированной с шистосомозом, отмечаются:

около
миллионов человек.
ЛАГ, ассоциированная с шистосомозом, выявляется у
с гепатолиенальной формой заболевания и является одной из ведущих причин ЛАГ в некоторых регионах Южной Америки, Африки и Азии.
с гепатолиенальной формой заболевания и является одной из ведущих причин ЛАГ в некоторых регионах Южной Америки, Африки и Азии.

пациентов



более высокий сердечный выброс;
низкие значения ЛСС;
хорошие показатели выживаемости,
в особенности на фоне применения ЛАГ-специфических препаратов33.
в особенности на фоне применения ЛАГ-специфических препаратов33.
пациента
В Санкт-Петербурге**:
Заболеваемость ЛАГ (I группа в целом) -
на
1 млн
1 млн
0,82 - 2,73



**Данные регистра ФГБУ НМИЦ им. В.А. Алмазова, не опубликовано



Наиболее ярким отличием регистра пациентов в РФ от регистров стран Запада является:

большая доля пациентов с ЛАГ, ассоциированной с ВПС, в структуре I группы ЛГ;
меньшее количество пациентов с ЛАГ, ассоциированной с СЗСТ и ВИЧ-инфекцией, портопульмональной ЛАГ.

Это свидетельствует о недостаточном взаимодействии с профильными специалистами и потребности информирования о необходимости скрининга ЛГ в группах риска.
Более молодая популяция пациентов с ЛАГ сигнализирует о недостаточном внимании возрастным пациентам, имеющим сердечно-легочную коморбидность, симптомы которой длительно маскируют проявления ЛГ.
населения в год
Заболеваемость ИЛАГ –
0,2 - 1,6
пациента на
населения
в год, что говорит о низком выявлении
БКК – блокаторы кальциевых каналов;
ВОЗ – Всемирная организация здравоохранения;
ВИЧ – вирус иммунодефицита человека;
ВПС – врожденные пороки сердца;
ДЛА – давление в легочной артерии;
ИЛАГ – идиопатическая легочная артериальная гипертензия; КПКС – катетеризация правых камер сердца;
ЛАГ – легочная артериальная гипертензия;
ЛАГ-ВИЧ – легочная артериальная гипертензия, ассоциированная с ВИЧ-инфекцией;
ЛАГ-ВПС – легочная артериальная гипертензия, ассоциированная с врожденными пороками сердца;
ЛАГ-ССД – легочная артериальная гипертензия, ассоциированная с системной склеродермией;
ЛВОБ – легочная веноокклюзионная болезнь;
ЛГ – легочная гипертензия;
ЛСС – легочное сосудистое сопротивление;
ППЛГ – портопульмональная легочная гипертензия;
РФ – Российская Федерация;
СЗСТ – системные заболевания соединительной ткани;
срДЛА – среднее давление в легочной артерии.
ССД – системная склеродермия;
США – Соединённые Штаты Америки;
ХСН – хроническая сердечная недостаточность;
ХТЭЛГ – хроническая тромбоэмболическая легочная гипертензия;
ФВ – фракция выброса;
ФК – функциональный класс;
ЭхоКГ – эхокардиография.
ВОЗ – Всемирная организация здравоохранения;
ВИЧ – вирус иммунодефицита человека;
ВПС – врожденные пороки сердца;
ДЛА – давление в легочной артерии;
ИЛАГ – идиопатическая легочная артериальная гипертензия; КПКС – катетеризация правых камер сердца;
ЛАГ – легочная артериальная гипертензия;
ЛАГ-ВИЧ – легочная артериальная гипертензия, ассоциированная с ВИЧ-инфекцией;
ЛАГ-ВПС – легочная артериальная гипертензия, ассоциированная с врожденными пороками сердца;
ЛАГ-ССД – легочная артериальная гипертензия, ассоциированная с системной склеродермией;
ЛВОБ – легочная веноокклюзионная болезнь;
ЛГ – легочная гипертензия;
ЛСС – легочное сосудистое сопротивление;
ППЛГ – портопульмональная легочная гипертензия;
РФ – Российская Федерация;
СЗСТ – системные заболевания соединительной ткани;
срДЛА – среднее давление в легочной артерии.
ССД – системная склеродермия;
США – Соединённые Штаты Америки;
ХСН – хроническая сердечная недостаточность;
ХТЭЛГ – хроническая тромбоэмболическая легочная гипертензия;
ФВ – фракция выброса;
ФК – функциональный класс;
ЭхоКГ – эхокардиография.
Литература
1.Leber, L., Beaudet, A., & Muller, A. (2021). Epidemiology of pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension: identification of the most accurate estimates from a systematic literature review. Pulmonary circulation, 11(1), 2045894020977300. https://doi.org/10.1177/ 2045894020977300.
2.Huluka DK, Mekonnen D, Abebe S, Meshesha A, Mekonnen D, Deyessa N, Klinger JR, Ventetuolo CE, Schluger NW, Sherman CB, Amogne W. Prevalence and risk factors of pulmonary hypertension among adult patients with HIV infection in Ethiopia. Pulm Circ. 2020 Nov 25;10(4):2045894020971518. doi: 10.1177/2045894020971518. PMID: 33282203; PMCID: PMC7691916.
3. Anderson, J. J., & Lau, E. M. (2022). Pulmonary Hypertension Definition, Classification, and Epidemiology in Asia. JACC. Asia, 2(5), 538–546. [https://doi.org/10.1016/j.jacasi.2022.04.008].
4.Frost AE, Badesch DB, Barst RJ, et al. The changing picture of patients with pulmonary arterial hypertension in the United States: how REVEAL differs from historic and non-US contemporary registries. Chest. 2011;139(1):128-137. doi: 10.1378/chest.10-0075.
5.Swinnen K, Quarck R, Godinas L, et al. Learning from registries in PAH: pitfalls and recommendations. Eur Respir Rev 2019; 28: 190050 [https://doi.org/10.1183/16000617.0050-2019].
6. Hoeper, M. M., Dwivedi, K., Pausch, C., Lewis, R. A., Olsson, K. M., Huscher, D., Pittrow, D., Grünig, E., Staehler, G., Vizza, C. D., Gall, H., Distler, O., Opitz, C., Gibbs, J. S. R., Delcroix, M., Park, D. H., Ghofrani, H. A., Ewert, R., Kaemmerer, H., Kabitz, H. J., … Halank, M. (2022). Phenotyping of idiopathic pulmonary arterial hypertension: a registry analysis. The Lancet. Respiratory medicine, 10(10), 937–948. https://doi.org/10.1016/S2213-2600(22)00097-2.
7. Sitbon, O., Humbert, M., Jaïs, X., Ioos, V., Hamid, A. M., Provencher, S., Garcia, G., Parent, F., Hervé, P., & Simonneau, G. (2005). Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation, 111(23), 3105–3111.
8. Morrell NW, Aldred MA, Chung WK, et al. Genetics and genomics of pulmonary arterial hypertension. Eur Respir J. 2019;53:1801899. doi: 1183/13993003.0189-2018.
9. Soubrier, F., Chung, W. K., Machado, R., Grünig, E., Aldred, M., Geraci, M., Loyd, J. E., Elliott, C. G., Trembath, R. C., Newman, J. H., & Humbert, M. (2013). Genetics and genomics of pulmonary arterial hypertension. Journal of the American College of Cardiology, 62(25 Suppl), D13–D21. https:// doi.org/10.1016/j.jacc.2013.10.035.
10. Badlam JB, Badesch DB, Austin ED, Benza RL, Chung WK, Farber HW, Feldkircher K, Frost AE, Poms AD, Lutz KA, Pauciulo MW, Yu C, Nichols WC, Elliott CG; USPHSR Investigators. United States Pulmonary Hypertension Scientific Registry: Baseline Characteristics. Chest. 2021 Jan;159(1):311-327. doi: 10.1016/j.chest.2020.07.088. Epub 2020 Aug 26. PMID: 32858008; PMCID: PMC7803940.
11. Humbert M. et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J; 2022; 43(38): 3618–3731.
12. Eyries M, Montani D, Girerd B, Perret C, Leroy A, Lonjou C, et al. EIF2AK4 mutations cause pulmonary veno-occlusive disease, a recessive form of pulmonary hypertension. Nat Genet 2014;46:65–69.
13. Szturmowicz, M., Kacprzak, A., Szołkowska, M., Burakowska, B., Szczepulska, E., & Kuś, J. (2018). Pulmonary veno-occlusive disease: pathogenesis, risk factors, clinical features and diagnostic algorithm - state of the art. Advances in respiratory medicine, 86(3), 10.5603/ARM.2018.0021. https:// doi.org/10.5603/ARM.2018.0021.
14. Montani D, Girerd B, Jais X, Levy M, Amar D, Savale L, et al. Clinical phenotypes and outcomes of heritable and sporadic pulmonary veno-occlusive disease: a population-based study. Lancet Respir Med 2017;5:125–134.
15. Balko, R., Edriss, H., Nugent, K., & Test, V. (2017). Pulmonary veno-occlusive disease: An important consideration in patients with pulmonary hypertension. Respiratory medicine, 132, 203–209. https://doi.org/10.1016/j.rmed.2017.10.015.
16. Avouac J, Airo P, Meune C, Beretta L, Dieude P, Caramaschi P, et al. Prevalence of pulmonary hypertension in systemic sclerosis in European Caucasians and metaanalysis of 5 studies. J Rheumatol 2010;37:2290–2298.
17. Yang X., Mardekian J., Sanders K.N., Mychaskiw M.A., Thomas J. Prevalence of pulmonary arterial hypertension in patients with connective tissue diseases: A systematic review of the literature. Clin. Rheumatol. 2013;32:1519–1531.
18. Weatherald J, Montani D, Jevnikar M, Jais X, Savale L, Humbert M. Screening for pulmonary arterial hypertension in systemic sclerosis. Eur Respir Rev 2019;28: 190023.
19. Semalulu T, Rudski L, Huynh T, Langleben D, Wang M, Canadian Scleroderma Research Group, et al. An evidence-based strategy to screen for pulmonary arterial hypertension in systemic sclerosis. Semin Arthritis Rheum 2020;50:1421–1427.
20 Coghlan JG, Wolf M, Distler O, Denton CP, Doelberg M, Harutyunova S, et al. Incidence of pulmonary hypertension and determining factors in patients with systemic sclerosis. Eur Respir J 2018;51:1701197.
21 Hassan, H. J., Naranjo, M., Ayoub, N., Housten, T., Hsu, S., Balasubramanian, A., Simpson, C. E., Damico, R. L., Mathai, S. C., Kolb, T. M., & Hassoun, P. M. (2023). Improved Survival for Patients with Systemic Sclerosis-associated Pulmonary Arterial Hypertension: The Johns Hopkins Registry. American journal of respiratory and critical care medicine, 207(3), 312–322.].
22 Launay D, Sobanski V, Hachulla E, Humbert M. Pulmonary hypertension in systemic sclerosis: different phenotypes. Eur Respir Rev 2017;26:170056].
23 Sitbon O, Lascoux-Combe C, Delfraissy JF, et al. Prevalence of HIV-related pulmonary arterial hypertension in the current antiretroviral therapy era. Am J Respir Crit Care Med 2008; 177: 108–113. [PMID: 17932378 DOI: 10.1164/rccm. 200704- 541OC].
24 Chillo P, Bakari M and Lwakatare J. Echocardiographic diagnoses in HIV-infected patients presenting with cardiac symptoms at Muhim-bili National Hospital in Dar Es Salaam, Tanzania. Cardiovas J Africa 2012; 23: 550–556.
25 Basyal, B., Jarrett, H., & Barnett, C. F. (2019). Pulmonary Hypertension in HIV. The Canadian journal of cardiology, 35(3), 288–298. https://doi.org/10.1016/j.cjca.2019.01.005.
26 Li J, Zhuang Q, Zhang X, Zheng Y, Qiao Z, Zhang J, et al. Prevalence and prognosis of portopulmonary hypertension in 223 liver transplant recipients. Can Respir J. 2018;2018:9629570.
27 Weatherald J, Bondeelle L, Chaumais MC, Guignabert C, Savale L, Jais X, et al. Pulmonary complications of Bcr-Abl tyrosine kinase inhibitors. Eur Respir J 2020; 56:2000279.
28 Zamanian RT, Hedlin H, Greuenwald P, Wilson DM, Segal JI, Jorden M, et al. Features and outcomes of methamphetamine-associated pulmonary arterial hypertension. Am J Respir Crit Care Med 2018;197:788–800.
29 van Riel AC, Schuuring MJ, van Hessen ID, Zwinderman AH, Cozijnsen L, Reichert CL, et al. Contemporary prevalence of pulmonary arterial hypertension in adult congenital heart disease following the updated clinical classification. Int J Cardiol 2014;174:299–305.
30 Lammers AE, Bauer LJ, Diller GP, Helm PC, Abdul-Khaliq H, Bauer UMM, et al. Pulmonary hypertension after shunt closure in patients with simple congenital heart defects. Int J Cardiol 2020;308:28–32.
31 Baumgartner, H., De Backer, J., Babu-Narayan, S. V., Budts, W., Chessa, M., Diller, G. P., Lung, B., Kluin, J., Lang, I. M., Meijboom, F., Moons, P., Mulder, B. J. M., Oechslin, E., Roos-Hesselink, J. W., Schwerzmann, M., Sondergaard, L., Zeppenfeld, K., & ESC Scientific Document Group (2021). 2020 ESC Guidelines for the management of adult congenital heart disease. European heart journal, 42(6), 563–645. https://doi.org/10.1093/eurheartj/ehaa554.
32 Manes, A., Palazzini, M., Leci, E., Bacchi Reggiani, M. L., Branzi, A., Galiè, N. Current era survival of patients with pulmonary arterial hypertension associated with congenital heart disease: a comparison between clinical subgroups. European heart journal; 2014; 35(11); 716–724. https:// doi.org/10.1093/eurheartj/eht072.
33 Fernandes CJC, Piloto B, Castro M, Gavilanes Oleas F, Alves JL Jr, Lopes Prada LF, et al. Survival of patients with schistosomiasis-associated pulmonary arterial hypertension in the modern management era. Eur Respir J 2018;51:1800307.
34 Chazova, I. Y., Martynyuk, T. V., Valieva, Z. S., Gratsianskaya, S. Y., Aleevskaya, A. M., Zorin, A. V., & Nakonechnikov, S. N. (2020). Clinical and Instrumental Characteristics of Newly Diagnosed Patients with Various Forms of Pulmonary Hypertension according to the Russian National Registry. BioMed research international, 2020, 6836973. https://doi.org/10.1155/2020/6836973.
35 Гончарова Н. С., Казымлы А. В., Наймушин А. В., Моисеева О. М. Современная терапия легочной артериальной гипертензии: анализ данных Северо-Западного регистра// Кардиоваскулярная терапия и профилактика .— 2012 .— №4 .— С. 79-84.
2.Huluka DK, Mekonnen D, Abebe S, Meshesha A, Mekonnen D, Deyessa N, Klinger JR, Ventetuolo CE, Schluger NW, Sherman CB, Amogne W. Prevalence and risk factors of pulmonary hypertension among adult patients with HIV infection in Ethiopia. Pulm Circ. 2020 Nov 25;10(4):2045894020971518. doi: 10.1177/2045894020971518. PMID: 33282203; PMCID: PMC7691916.
3. Anderson, J. J., & Lau, E. M. (2022). Pulmonary Hypertension Definition, Classification, and Epidemiology in Asia. JACC. Asia, 2(5), 538–546. [https://doi.org/10.1016/j.jacasi.2022.04.008].
4.Frost AE, Badesch DB, Barst RJ, et al. The changing picture of patients with pulmonary arterial hypertension in the United States: how REVEAL differs from historic and non-US contemporary registries. Chest. 2011;139(1):128-137. doi: 10.1378/chest.10-0075.
5.Swinnen K, Quarck R, Godinas L, et al. Learning from registries in PAH: pitfalls and recommendations. Eur Respir Rev 2019; 28: 190050 [https://doi.org/10.1183/16000617.0050-2019].
6. Hoeper, M. M., Dwivedi, K., Pausch, C., Lewis, R. A., Olsson, K. M., Huscher, D., Pittrow, D., Grünig, E., Staehler, G., Vizza, C. D., Gall, H., Distler, O., Opitz, C., Gibbs, J. S. R., Delcroix, M., Park, D. H., Ghofrani, H. A., Ewert, R., Kaemmerer, H., Kabitz, H. J., … Halank, M. (2022). Phenotyping of idiopathic pulmonary arterial hypertension: a registry analysis. The Lancet. Respiratory medicine, 10(10), 937–948. https://doi.org/10.1016/S2213-2600(22)00097-2.
7. Sitbon, O., Humbert, M., Jaïs, X., Ioos, V., Hamid, A. M., Provencher, S., Garcia, G., Parent, F., Hervé, P., & Simonneau, G. (2005). Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation, 111(23), 3105–3111.
8. Morrell NW, Aldred MA, Chung WK, et al. Genetics and genomics of pulmonary arterial hypertension. Eur Respir J. 2019;53:1801899. doi: 1183/13993003.0189-2018.
9. Soubrier, F., Chung, W. K., Machado, R., Grünig, E., Aldred, M., Geraci, M., Loyd, J. E., Elliott, C. G., Trembath, R. C., Newman, J. H., & Humbert, M. (2013). Genetics and genomics of pulmonary arterial hypertension. Journal of the American College of Cardiology, 62(25 Suppl), D13–D21. https:// doi.org/10.1016/j.jacc.2013.10.035.
10. Badlam JB, Badesch DB, Austin ED, Benza RL, Chung WK, Farber HW, Feldkircher K, Frost AE, Poms AD, Lutz KA, Pauciulo MW, Yu C, Nichols WC, Elliott CG; USPHSR Investigators. United States Pulmonary Hypertension Scientific Registry: Baseline Characteristics. Chest. 2021 Jan;159(1):311-327. doi: 10.1016/j.chest.2020.07.088. Epub 2020 Aug 26. PMID: 32858008; PMCID: PMC7803940.
11. Humbert M. et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J; 2022; 43(38): 3618–3731.
12. Eyries M, Montani D, Girerd B, Perret C, Leroy A, Lonjou C, et al. EIF2AK4 mutations cause pulmonary veno-occlusive disease, a recessive form of pulmonary hypertension. Nat Genet 2014;46:65–69.
13. Szturmowicz, M., Kacprzak, A., Szołkowska, M., Burakowska, B., Szczepulska, E., & Kuś, J. (2018). Pulmonary veno-occlusive disease: pathogenesis, risk factors, clinical features and diagnostic algorithm - state of the art. Advances in respiratory medicine, 86(3), 10.5603/ARM.2018.0021. https:// doi.org/10.5603/ARM.2018.0021.
14. Montani D, Girerd B, Jais X, Levy M, Amar D, Savale L, et al. Clinical phenotypes and outcomes of heritable and sporadic pulmonary veno-occlusive disease: a population-based study. Lancet Respir Med 2017;5:125–134.
15. Balko, R., Edriss, H., Nugent, K., & Test, V. (2017). Pulmonary veno-occlusive disease: An important consideration in patients with pulmonary hypertension. Respiratory medicine, 132, 203–209. https://doi.org/10.1016/j.rmed.2017.10.015.
16. Avouac J, Airo P, Meune C, Beretta L, Dieude P, Caramaschi P, et al. Prevalence of pulmonary hypertension in systemic sclerosis in European Caucasians and metaanalysis of 5 studies. J Rheumatol 2010;37:2290–2298.
17. Yang X., Mardekian J., Sanders K.N., Mychaskiw M.A., Thomas J. Prevalence of pulmonary arterial hypertension in patients with connective tissue diseases: A systematic review of the literature. Clin. Rheumatol. 2013;32:1519–1531.
18. Weatherald J, Montani D, Jevnikar M, Jais X, Savale L, Humbert M. Screening for pulmonary arterial hypertension in systemic sclerosis. Eur Respir Rev 2019;28: 190023.
19. Semalulu T, Rudski L, Huynh T, Langleben D, Wang M, Canadian Scleroderma Research Group, et al. An evidence-based strategy to screen for pulmonary arterial hypertension in systemic sclerosis. Semin Arthritis Rheum 2020;50:1421–1427.
20 Coghlan JG, Wolf M, Distler O, Denton CP, Doelberg M, Harutyunova S, et al. Incidence of pulmonary hypertension and determining factors in patients with systemic sclerosis. Eur Respir J 2018;51:1701197.
21 Hassan, H. J., Naranjo, M., Ayoub, N., Housten, T., Hsu, S., Balasubramanian, A., Simpson, C. E., Damico, R. L., Mathai, S. C., Kolb, T. M., & Hassoun, P. M. (2023). Improved Survival for Patients with Systemic Sclerosis-associated Pulmonary Arterial Hypertension: The Johns Hopkins Registry. American journal of respiratory and critical care medicine, 207(3), 312–322.].
22 Launay D, Sobanski V, Hachulla E, Humbert M. Pulmonary hypertension in systemic sclerosis: different phenotypes. Eur Respir Rev 2017;26:170056].
23 Sitbon O, Lascoux-Combe C, Delfraissy JF, et al. Prevalence of HIV-related pulmonary arterial hypertension in the current antiretroviral therapy era. Am J Respir Crit Care Med 2008; 177: 108–113. [PMID: 17932378 DOI: 10.1164/rccm. 200704- 541OC].
24 Chillo P, Bakari M and Lwakatare J. Echocardiographic diagnoses in HIV-infected patients presenting with cardiac symptoms at Muhim-bili National Hospital in Dar Es Salaam, Tanzania. Cardiovas J Africa 2012; 23: 550–556.
25 Basyal, B., Jarrett, H., & Barnett, C. F. (2019). Pulmonary Hypertension in HIV. The Canadian journal of cardiology, 35(3), 288–298. https://doi.org/10.1016/j.cjca.2019.01.005.
26 Li J, Zhuang Q, Zhang X, Zheng Y, Qiao Z, Zhang J, et al. Prevalence and prognosis of portopulmonary hypertension in 223 liver transplant recipients. Can Respir J. 2018;2018:9629570.
27 Weatherald J, Bondeelle L, Chaumais MC, Guignabert C, Savale L, Jais X, et al. Pulmonary complications of Bcr-Abl tyrosine kinase inhibitors. Eur Respir J 2020; 56:2000279.
28 Zamanian RT, Hedlin H, Greuenwald P, Wilson DM, Segal JI, Jorden M, et al. Features and outcomes of methamphetamine-associated pulmonary arterial hypertension. Am J Respir Crit Care Med 2018;197:788–800.
29 van Riel AC, Schuuring MJ, van Hessen ID, Zwinderman AH, Cozijnsen L, Reichert CL, et al. Contemporary prevalence of pulmonary arterial hypertension in adult congenital heart disease following the updated clinical classification. Int J Cardiol 2014;174:299–305.
30 Lammers AE, Bauer LJ, Diller GP, Helm PC, Abdul-Khaliq H, Bauer UMM, et al. Pulmonary hypertension after shunt closure in patients with simple congenital heart defects. Int J Cardiol 2020;308:28–32.
31 Baumgartner, H., De Backer, J., Babu-Narayan, S. V., Budts, W., Chessa, M., Diller, G. P., Lung, B., Kluin, J., Lang, I. M., Meijboom, F., Moons, P., Mulder, B. J. M., Oechslin, E., Roos-Hesselink, J. W., Schwerzmann, M., Sondergaard, L., Zeppenfeld, K., & ESC Scientific Document Group (2021). 2020 ESC Guidelines for the management of adult congenital heart disease. European heart journal, 42(6), 563–645. https://doi.org/10.1093/eurheartj/ehaa554.
32 Manes, A., Palazzini, M., Leci, E., Bacchi Reggiani, M. L., Branzi, A., Galiè, N. Current era survival of patients with pulmonary arterial hypertension associated with congenital heart disease: a comparison between clinical subgroups. European heart journal; 2014; 35(11); 716–724. https:// doi.org/10.1093/eurheartj/eht072.
33 Fernandes CJC, Piloto B, Castro M, Gavilanes Oleas F, Alves JL Jr, Lopes Prada LF, et al. Survival of patients with schistosomiasis-associated pulmonary arterial hypertension in the modern management era. Eur Respir J 2018;51:1800307.
34 Chazova, I. Y., Martynyuk, T. V., Valieva, Z. S., Gratsianskaya, S. Y., Aleevskaya, A. M., Zorin, A. V., & Nakonechnikov, S. N. (2020). Clinical and Instrumental Characteristics of Newly Diagnosed Patients with Various Forms of Pulmonary Hypertension according to the Russian National Registry. BioMed research international, 2020, 6836973. https://doi.org/10.1155/2020/6836973.
35 Гончарова Н. С., Казымлы А. В., Наймушин А. В., Моисеева О. М. Современная терапия легочной артериальной гипертензии: анализ данных Северо-Западного регистра// Кардиоваскулярная терапия и профилактика .— 2012 .— №4 .— С. 79-84.
1.Leber, L., Beaudet, A., & Muller, A. (2021). Epidemiology of pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension: identification of the most accurate estimates from a systematic literature review. Pulmonary circulation, 11(1), 2045894020977300. https://doi.org/10.1177/ 2045894020977300.
2.Huluka DK, Mekonnen D, Abebe S, Meshesha A, Mekonnen D, Deyessa N, Klinger JR, Ventetuolo CE, Schluger NW, Sherman CB, Amogne W. Prevalence and risk factors of pulmonary hypertension among adult patients with HIV infection in Ethiopia. Pulm Circ. 2020 Nov 25;10(4):2045894020971518. doi: 10.1177/2045894020971518. PMID: 33282203; PMCID: PMC7691916.
3. Anderson, J. J., & Lau, E. M. (2022). Pulmonary Hypertension Definition, Classification, and Epidemiology in Asia. JACC. Asia, 2(5), 538–546. [https://doi.org/10.1016/j.jacasi.2022.04.008].
4.Frost AE, Badesch DB, Barst RJ, et al. The changing picture of patients with pulmonary arterial hypertension in the United States: how REVEAL differs from historic and non-US contemporary registries. Chest. 2011;139(1):128-137. doi: 10.1378/chest.10-0075.
5.Swinnen K, Quarck R, Godinas L, et al. Learning from registries in PAH: pitfalls and recommendations. Eur Respir Rev 2019; 28: 190050 [https://doi.org/10.1183/16000617.0050-2019].
6. Hoeper, M. M., Dwivedi, K., Pausch, C., Lewis, R. A., Olsson, K. M., Huscher, D., Pittrow, D., Grünig, E., Staehler, G., Vizza, C. D., Gall, H., Distler, O., Opitz, C., Gibbs, J. S. R., Delcroix, M., Park, D. H., Ghofrani, H. A., Ewert, R., Kaemmerer, H., Kabitz, H. J., … Halank, M. (2022). Phenotyping of idiopathic pulmonary arterial hypertension: a registry analysis. The Lancet. Respiratory medicine, 10(10), 937–948. https://doi.org/10.1016/S2213-2600(22)00097-2.
7. Sitbon, O., Humbert, M., Jaïs, X., Ioos, V., Hamid, A. M., Provencher, S., Garcia, G., Parent, F., Hervé, P., & Simonneau, G. (2005). Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation, 111(23), 3105–3111.
8. Morrell NW, Aldred MA, Chung WK, et al. Genetics and genomics of pulmonary arterial hypertension. Eur Respir J. 2019;53:1801899. doi: 1183/13993003.0189-2018.
9. Soubrier, F., Chung, W. K., Machado, R., Grünig, E., Aldred, M., Geraci, M., Loyd, J. E., Elliott, C. G., Trembath, R. C., Newman, J. H., & Humbert, M. (2013). Genetics and genomics of pulmonary arterial hypertension. Journal of the American College of Cardiology, 62(25 Suppl), D13–D21. https:// doi.org/10.1016/j.jacc.2013.10.035.
10. Badlam JB, Badesch DB, Austin ED, Benza RL, Chung WK, Farber HW, Feldkircher K, Frost AE, Poms AD, Lutz KA, Pauciulo MW, Yu C, Nichols WC, Elliott CG; USPHSR Investigators. United States Pulmonary Hypertension Scientific Registry: Baseline Characteristics. Chest. 2021 Jan;159(1):311-327. doi: 10.1016/j.chest.2020.07.088. Epub 2020 Aug 26. PMID: 32858008; PMCID: PMC7803940.
11. Humbert M. et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J; 2022; 43(38): 3618–3731.
12. Eyries M, Montani D, Girerd B, Perret C, Leroy A, Lonjou C, et al. EIF2AK4 mutations cause pulmonary veno-occlusive disease, a recessive form of pulmonary hypertension. Nat Genet 2014;46:65–69.
13. Szturmowicz, M., Kacprzak, A., Szołkowska, M., Burakowska, B., Szczepulska, E., & Kuś, J. (2018). Pulmonary veno-occlusive disease: pathogenesis, risk factors, clinical features and diagnostic algorithm - state of the art. Advances in respiratory medicine, 86(3), 10.5603/ARM.2018.0021. https:// doi.org/10.5603/ARM.2018.0021.
14. Montani D, Girerd B, Jais X, Levy M, Amar D, Savale L, et al. Clinical phenotypes and outcomes of heritable and sporadic pulmonary veno-occlusive disease: a population-based study. Lancet Respir Med 2017;5:125–134.
15. Balko, R., Edriss, H., Nugent, K., & Test, V. (2017). Pulmonary veno-occlusive disease: An important consideration in patients with pulmonary hypertension. Respiratory medicine, 132, 203–209. https://doi.org/10.1016/j.rmed.2017.10.015.
16. Avouac J, Airo P, Meune C, Beretta L, Dieude P, Caramaschi P, et al. Prevalence of pulmonary hypertension in systemic sclerosis in European Caucasians and metaanalysis of 5 studies. J Rheumatol 2010;37:2290–2298.
17. Yang X., Mardekian J., Sanders K.N., Mychaskiw M.A., Thomas J. Prevalence of pulmonary arterial hypertension in patients with connective tissue diseases: A systematic review of the literature. Clin. Rheumatol. 2013;32:1519–1531.
18. Weatherald J, Montani D, Jevnikar M, Jais X, Savale L, Humbert M. Screening for pulmonary arterial hypertension in systemic sclerosis. Eur Respir Rev 2019;28: 190023.
19. Semalulu T, Rudski L, Huynh T, Langleben D, Wang M, Canadian Scleroderma Research Group, et al. An evidence-based strategy to screen for pulmonary arterial hypertension in systemic sclerosis. Semin Arthritis Rheum 2020;50:1421–1427.
20 Coghlan JG, Wolf M, Distler O, Denton CP, Doelberg M, Harutyunova S, et al. Incidence of pulmonary hypertension and determining factors in patients with systemic sclerosis. Eur Respir J 2018;51:1701197.
21 Hassan, H. J., Naranjo, M., Ayoub, N., Housten, T., Hsu, S., Balasubramanian, A., Simpson, C. E., Damico, R. L., Mathai, S. C., Kolb, T. M., & Hassoun, P. M. (2023). Improved Survival for Patients with Systemic Sclerosis-associated Pulmonary Arterial Hypertension: The Johns Hopkins Registry. American journal of respiratory and critical care medicine, 207(3), 312–322.].
22 Launay D, Sobanski V, Hachulla E, Humbert M. Pulmonary hypertension in systemic sclerosis: different phenotypes. Eur Respir Rev 2017;26:170056].
23 Sitbon O, Lascoux-Combe C, Delfraissy JF, et al. Prevalence of HIV-related pulmonary arterial hypertension in the current antiretroviral therapy era. Am J Respir Crit Care Med 2008; 177: 108–113. [PMID: 17932378 DOI: 10.1164/rccm. 200704- 541OC].
24 Chillo P, Bakari M and Lwakatare J. Echocardiographic diagnoses in HIV-infected patients presenting with cardiac symptoms at Muhim-bili National Hospital in Dar Es Salaam, Tanzania. Cardiovas J Africa 2012; 23: 550–556.
25 Basyal, B., Jarrett, H., & Barnett, C. F. (2019). Pulmonary Hypertension in HIV. The Canadian journal of cardiology, 35(3), 288–298. https://doi.org/10.1016/j.cjca.2019.01.005.
26 Li J, Zhuang Q, Zhang X, Zheng Y, Qiao Z, Zhang J, et al. Prevalence and prognosis of portopulmonary hypertension in 223 liver transplant recipients. Can Respir J. 2018;2018:9629570.
27 Weatherald J, Bondeelle L, Chaumais MC, Guignabert C, Savale L, Jais X, et al. Pulmonary complications of Bcr-Abl tyrosine kinase inhibitors. Eur Respir J 2020; 56:2000279.
28 Zamanian RT, Hedlin H, Greuenwald P, Wilson DM, Segal JI, Jorden M, et al. Features and outcomes of methamphetamine-associated pulmonary arterial hypertension. Am J Respir Crit Care Med 2018;197:788–800.
29 van Riel AC, Schuuring MJ, van Hessen ID, Zwinderman AH, Cozijnsen L, Reichert CL, et al. Contemporary prevalence of pulmonary arterial hypertension in adult congenital heart disease following the updated clinical classification. Int J Cardiol 2014;174:299–305.
30 Lammers AE, Bauer LJ, Diller GP, Helm PC, Abdul-Khaliq H, Bauer UMM, et al. Pulmonary hypertension after shunt closure in patients with simple congenital heart defects. Int J Cardiol 2020;308:28–32.
31 Baumgartner, H., De Backer, J., Babu-Narayan, S. V., Budts, W., Chessa, M., Diller, G. P., Lung, B., Kluin, J., Lang, I. M., Meijboom, F., Moons, P., Mulder, B. J. M., Oechslin, E., Roos-Hesselink, J. W., Schwerzmann, M., Sondergaard, L., Zeppenfeld, K., & ESC Scientific Document Group (2021). 2020 ESC Guidelines for the management of adult congenital heart disease. European heart journal, 42(6), 563–645. https://doi.org/10.1093/eurheartj/ehaa554.
32 Manes, A., Palazzini, M., Leci, E., Bacchi Reggiani, M. L., Branzi, A., Galiè, N. Current era survival of patients with pulmonary arterial hypertension associated with congenital heart disease: a comparison between clinical subgroups. European heart journal; 2014; 35(11); 716–724. https:// doi.org/10.1093/eurheartj/eht072.
33 Fernandes CJC, Piloto B, Castro M, Gavilanes Oleas F, Alves JL Jr, Lopes Prada LF, et al. Survival of patients with schistosomiasis-associated pulmonary arterial hypertension in the modern management era. Eur Respir J 2018;51:1800307.
34 Chazova, I. Y., Martynyuk, T. V., Valieva, Z. S., Gratsianskaya, S. Y., Aleevskaya, A. M., Zorin, A. V., & Nakonechnikov, S. N. (2020). Clinical and Instrumental Characteristics of Newly Diagnosed Patients with Various Forms of Pulmonary Hypertension according to the Russian National Registry. BioMed research international, 2020, 6836973. https://doi.org/10.1155/2020/6836973.
35 Гончарова Н. С., Казымлы А. В., Наймушин А. В., Моисеева О. М. Современная терапия легочной артериальной гипертензии: анализ данных Северо-Западного регистра// Кардиоваскулярная терапия и профилактика .— 2012 .— №4 .— С. 79-84.
2.Huluka DK, Mekonnen D, Abebe S, Meshesha A, Mekonnen D, Deyessa N, Klinger JR, Ventetuolo CE, Schluger NW, Sherman CB, Amogne W. Prevalence and risk factors of pulmonary hypertension among adult patients with HIV infection in Ethiopia. Pulm Circ. 2020 Nov 25;10(4):2045894020971518. doi: 10.1177/2045894020971518. PMID: 33282203; PMCID: PMC7691916.
3. Anderson, J. J., & Lau, E. M. (2022). Pulmonary Hypertension Definition, Classification, and Epidemiology in Asia. JACC. Asia, 2(5), 538–546. [https://doi.org/10.1016/j.jacasi.2022.04.008].
4.Frost AE, Badesch DB, Barst RJ, et al. The changing picture of patients with pulmonary arterial hypertension in the United States: how REVEAL differs from historic and non-US contemporary registries. Chest. 2011;139(1):128-137. doi: 10.1378/chest.10-0075.
5.Swinnen K, Quarck R, Godinas L, et al. Learning from registries in PAH: pitfalls and recommendations. Eur Respir Rev 2019; 28: 190050 [https://doi.org/10.1183/16000617.0050-2019].
6. Hoeper, M. M., Dwivedi, K., Pausch, C., Lewis, R. A., Olsson, K. M., Huscher, D., Pittrow, D., Grünig, E., Staehler, G., Vizza, C. D., Gall, H., Distler, O., Opitz, C., Gibbs, J. S. R., Delcroix, M., Park, D. H., Ghofrani, H. A., Ewert, R., Kaemmerer, H., Kabitz, H. J., … Halank, M. (2022). Phenotyping of idiopathic pulmonary arterial hypertension: a registry analysis. The Lancet. Respiratory medicine, 10(10), 937–948. https://doi.org/10.1016/S2213-2600(22)00097-2.
7. Sitbon, O., Humbert, M., Jaïs, X., Ioos, V., Hamid, A. M., Provencher, S., Garcia, G., Parent, F., Hervé, P., & Simonneau, G. (2005). Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation, 111(23), 3105–3111.
8. Morrell NW, Aldred MA, Chung WK, et al. Genetics and genomics of pulmonary arterial hypertension. Eur Respir J. 2019;53:1801899. doi: 1183/13993003.0189-2018.
9. Soubrier, F., Chung, W. K., Machado, R., Grünig, E., Aldred, M., Geraci, M., Loyd, J. E., Elliott, C. G., Trembath, R. C., Newman, J. H., & Humbert, M. (2013). Genetics and genomics of pulmonary arterial hypertension. Journal of the American College of Cardiology, 62(25 Suppl), D13–D21. https:// doi.org/10.1016/j.jacc.2013.10.035.
10. Badlam JB, Badesch DB, Austin ED, Benza RL, Chung WK, Farber HW, Feldkircher K, Frost AE, Poms AD, Lutz KA, Pauciulo MW, Yu C, Nichols WC, Elliott CG; USPHSR Investigators. United States Pulmonary Hypertension Scientific Registry: Baseline Characteristics. Chest. 2021 Jan;159(1):311-327. doi: 10.1016/j.chest.2020.07.088. Epub 2020 Aug 26. PMID: 32858008; PMCID: PMC7803940.
11. Humbert M. et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J; 2022; 43(38): 3618–3731.
12. Eyries M, Montani D, Girerd B, Perret C, Leroy A, Lonjou C, et al. EIF2AK4 mutations cause pulmonary veno-occlusive disease, a recessive form of pulmonary hypertension. Nat Genet 2014;46:65–69.
13. Szturmowicz, M., Kacprzak, A., Szołkowska, M., Burakowska, B., Szczepulska, E., & Kuś, J. (2018). Pulmonary veno-occlusive disease: pathogenesis, risk factors, clinical features and diagnostic algorithm - state of the art. Advances in respiratory medicine, 86(3), 10.5603/ARM.2018.0021. https:// doi.org/10.5603/ARM.2018.0021.
14. Montani D, Girerd B, Jais X, Levy M, Amar D, Savale L, et al. Clinical phenotypes and outcomes of heritable and sporadic pulmonary veno-occlusive disease: a population-based study. Lancet Respir Med 2017;5:125–134.
15. Balko, R., Edriss, H., Nugent, K., & Test, V. (2017). Pulmonary veno-occlusive disease: An important consideration in patients with pulmonary hypertension. Respiratory medicine, 132, 203–209. https://doi.org/10.1016/j.rmed.2017.10.015.
16. Avouac J, Airo P, Meune C, Beretta L, Dieude P, Caramaschi P, et al. Prevalence of pulmonary hypertension in systemic sclerosis in European Caucasians and metaanalysis of 5 studies. J Rheumatol 2010;37:2290–2298.
17. Yang X., Mardekian J., Sanders K.N., Mychaskiw M.A., Thomas J. Prevalence of pulmonary arterial hypertension in patients with connective tissue diseases: A systematic review of the literature. Clin. Rheumatol. 2013;32:1519–1531.
18. Weatherald J, Montani D, Jevnikar M, Jais X, Savale L, Humbert M. Screening for pulmonary arterial hypertension in systemic sclerosis. Eur Respir Rev 2019;28: 190023.
19. Semalulu T, Rudski L, Huynh T, Langleben D, Wang M, Canadian Scleroderma Research Group, et al. An evidence-based strategy to screen for pulmonary arterial hypertension in systemic sclerosis. Semin Arthritis Rheum 2020;50:1421–1427.
20 Coghlan JG, Wolf M, Distler O, Denton CP, Doelberg M, Harutyunova S, et al. Incidence of pulmonary hypertension and determining factors in patients with systemic sclerosis. Eur Respir J 2018;51:1701197.
21 Hassan, H. J., Naranjo, M., Ayoub, N., Housten, T., Hsu, S., Balasubramanian, A., Simpson, C. E., Damico, R. L., Mathai, S. C., Kolb, T. M., & Hassoun, P. M. (2023). Improved Survival for Patients with Systemic Sclerosis-associated Pulmonary Arterial Hypertension: The Johns Hopkins Registry. American journal of respiratory and critical care medicine, 207(3), 312–322.].
22 Launay D, Sobanski V, Hachulla E, Humbert M. Pulmonary hypertension in systemic sclerosis: different phenotypes. Eur Respir Rev 2017;26:170056].
23 Sitbon O, Lascoux-Combe C, Delfraissy JF, et al. Prevalence of HIV-related pulmonary arterial hypertension in the current antiretroviral therapy era. Am J Respir Crit Care Med 2008; 177: 108–113. [PMID: 17932378 DOI: 10.1164/rccm. 200704- 541OC].
24 Chillo P, Bakari M and Lwakatare J. Echocardiographic diagnoses in HIV-infected patients presenting with cardiac symptoms at Muhim-bili National Hospital in Dar Es Salaam, Tanzania. Cardiovas J Africa 2012; 23: 550–556.
25 Basyal, B., Jarrett, H., & Barnett, C. F. (2019). Pulmonary Hypertension in HIV. The Canadian journal of cardiology, 35(3), 288–298. https://doi.org/10.1016/j.cjca.2019.01.005.
26 Li J, Zhuang Q, Zhang X, Zheng Y, Qiao Z, Zhang J, et al. Prevalence and prognosis of portopulmonary hypertension in 223 liver transplant recipients. Can Respir J. 2018;2018:9629570.
27 Weatherald J, Bondeelle L, Chaumais MC, Guignabert C, Savale L, Jais X, et al. Pulmonary complications of Bcr-Abl tyrosine kinase inhibitors. Eur Respir J 2020; 56:2000279.
28 Zamanian RT, Hedlin H, Greuenwald P, Wilson DM, Segal JI, Jorden M, et al. Features and outcomes of methamphetamine-associated pulmonary arterial hypertension. Am J Respir Crit Care Med 2018;197:788–800.
29 van Riel AC, Schuuring MJ, van Hessen ID, Zwinderman AH, Cozijnsen L, Reichert CL, et al. Contemporary prevalence of pulmonary arterial hypertension in adult congenital heart disease following the updated clinical classification. Int J Cardiol 2014;174:299–305.
30 Lammers AE, Bauer LJ, Diller GP, Helm PC, Abdul-Khaliq H, Bauer UMM, et al. Pulmonary hypertension after shunt closure in patients with simple congenital heart defects. Int J Cardiol 2020;308:28–32.
31 Baumgartner, H., De Backer, J., Babu-Narayan, S. V., Budts, W., Chessa, M., Diller, G. P., Lung, B., Kluin, J., Lang, I. M., Meijboom, F., Moons, P., Mulder, B. J. M., Oechslin, E., Roos-Hesselink, J. W., Schwerzmann, M., Sondergaard, L., Zeppenfeld, K., & ESC Scientific Document Group (2021). 2020 ESC Guidelines for the management of adult congenital heart disease. European heart journal, 42(6), 563–645. https://doi.org/10.1093/eurheartj/ehaa554.
32 Manes, A., Palazzini, M., Leci, E., Bacchi Reggiani, M. L., Branzi, A., Galiè, N. Current era survival of patients with pulmonary arterial hypertension associated with congenital heart disease: a comparison between clinical subgroups. European heart journal; 2014; 35(11); 716–724. https:// doi.org/10.1093/eurheartj/eht072.
33 Fernandes CJC, Piloto B, Castro M, Gavilanes Oleas F, Alves JL Jr, Lopes Prada LF, et al. Survival of patients with schistosomiasis-associated pulmonary arterial hypertension in the modern management era. Eur Respir J 2018;51:1800307.
34 Chazova, I. Y., Martynyuk, T. V., Valieva, Z. S., Gratsianskaya, S. Y., Aleevskaya, A. M., Zorin, A. V., & Nakonechnikov, S. N. (2020). Clinical and Instrumental Characteristics of Newly Diagnosed Patients with Various Forms of Pulmonary Hypertension according to the Russian National Registry. BioMed research international, 2020, 6836973. https://doi.org/10.1155/2020/6836973.
35 Гончарова Н. С., Казымлы А. В., Наймушин А. В., Моисеева О. М. Современная терапия легочной артериальной гипертензии: анализ данных Северо-Западного регистра// Кардиоваскулярная терапия и профилактика .— 2012 .— №4 .— С. 79-84.
Продолжить чтение
Материал предназначен исключительно для медицинских и фармацевтических работников.
СР-396950, июль 2023.
ООО "Джонсон & Джонсон", 121614, Москва, ул. Крылатская, д.17, корп. 2.
тел.: +7 (495) 755-83-57, факс: +7 (495) 755-83-58.
СР-396950, июль 2023.
ООО "Джонсон & Джонсон", 121614, Москва, ул. Крылатская, д.17, корп. 2.
тел.: +7 (495) 755-83-57, факс: +7 (495) 755-83-58.

